Gezielte Präventionsmaßnahmen und Prozesshygiene in der Tiermedizin
Prävention von postoperativen Wundinfektionen (SSI)
Das Ziel aller Hygienemaßnahmen ist die Reduktion von postoperativen Wundinfektionen und anderen nosokomialen Infektionen, sowie der Schutz der Mitarbeitenden vor berufsbedingten Infektionen. Um die Infektionsrate so gering wie möglich zu halten, sollte man den gesamten Prozess betrachten und optimieren sowie Bundle-Strategien entwickeln.
Fokusthema
Postoperative Wundinfektionen
Postoperative Wundinfektionen in der Veterinärmedizin (SSI – Surgical Site Infections)
Zur gezielten Prävention postoperativer Wundinfektionen sollten folgende Prozesse betrachtet werden.
Allgemeine Anforderung an den OP
Allgemeine Anforderung an den OP
- Ausrichtung der Bauplanung an den hygienischen Anforderungen in Bezug auf den Bedarf der Einrichtung (Spektrum der Operationen)
- Effiziente Gestaltung der Arbeitsabläufe (Arbeitsanweisungen)
- Erfahrenes und geschultes Personal
- Ausreichendes und an die durchzuführenden Operationen adaptiertes Instrumentarium
- Konsequente Einhaltung aller Hygienemaßnahmen (vor allem der Regeln zur Händedesinfektion)
- Fugendichter Bodenbelag, gut zu reinigen und widerstandsfähig gegen gebräuchliche Flächen- und alkoholische Händedesinfektionsmittel, ebenso Wände und Decken im OP- Raum
- Sicher zu desinfizierende Oberflächen, Einrichtungsgegenstände und Geräte
- Geeignete Waschmöglichkeiten außerhalb der OP-Räume
- Ausreichende Anzahl von Spendern für Händedesinfektionsmittel in der OP-Einheit
- Geeignete OP-Wäsche und Patientenabdeckmaterialien nach DIN EN 13795:2013:10
- Präoperative Vorbereitungszone mit räumlicher oder zumindest funktioneller Abtrennung
- Bedarfsorientierte Anzahl von ausreichend großen OP-Räumen
- Angemessen große Arbeitsflächen zur Vorbereitung von Infusionen und Injektionen
- Ausreichender Lagerraum und Schränke/Regale zur Lagerung von Sterilgut, Medikamenten, Infusionen, OP-Wäsche und Geräten
- Ausreichende Flächen für Sammelbehälter zur Entsorgung von OP-Wäsche und anderem Abfall
- Separater Raum für Reinigungsutensilien (Putzwagen etc.), evtl. Kombination von Putz und Entsorgungsraum
- Schleusen mit Umkleideraum für das Personal
- Ausreichend großer Raum zur Aufbereitung- und Sterilisation der Instrumente
- Sofern getrennte Räume als unreiner bzw. reiner Arbeitsbereich nicht zur Verfügung stehen, ist die Einrichtung des Raumes so zu gestalten, dass eine funktionelle Trennung unreiner und reiner Arbeitsabläufe gewährleistet ist
Gezielte Prävention: Patient
Gezielte Prävention: Patient
Präoperative Untersuchung des Patienten/Dekolonisation: Der Gesundheitsstatus des Patienten ist ein wichtiger Risikofaktor für das SSI Risiko (postoperative Wundinfektionen). [1, 2] Daher sollten die Patienten vor einer Operation gründlich untersucht werden und ggf. Erkrankungen und oder lokale Hautinfektionen möglichst vor der Operation diagnostiziert und behandelt werden.
Optimierung der Anästhesiezeit: Die Gesamtdauer der Anästhesie hat, ebenso wie die Gesamtdauer der Operation, einen Einfluss auf die SSI Rate [2-4] und sollte daher so kurz wie möglich gehalten werden. Dies kann durch eine gute Planung des OP Tages und eine Optimierung der allgemeinen Abläufe erreicht werden.
Normothermie: Die perioperative Hypothermie ist in der Humanmedizin mit einer erhöhten SSI Rate verbunden. In der Tiermedizin gibt es dazu weniger eindeutige Evidenz, allerdings ist eine Hypothermie mit einer Verlängerung der Aufwachphase und damit der Anästhesiezeit verbunden [5, 6] und diese hat einen signifikanten Effekt auf die SSI Rate. [2-4, 7] Außerdem geht die perioperative Hypothermie mit einer erhöhten Mortalitätsrate bei Notfallprozeduren einher. [8] Daher sollte die Temperatur des Patienten Teil des regulären Monitorings sein, um ggf. therapeutische Maßnahmen ergreifen zu können.
Hypotension: Tiere, die während der Operation hypotensiv werden, haben eine 27-fach höhere Wahrscheinlichkeit, eine postoperative Wundinfektion zu entwickeln. Daher sollte der Blutdruck während der gesamten Zeit der Anästhesie überwacht und ggf. therapiert werden. [9]
Oxygenierung: Hypoxie wurde in zahlreichen Studien in der Humanmedizin als Risikofaktor für SSI beschrieben. [10-12] Daher sollte während der gesamten OP und der Anästhesiezeit die Oxygenierung gemonitort und ggf. korrigiert werden.
Glucose: Perioperative Hyperglykämie ist mit einer erhöhten SSI-Rate assoziiert. [13-15] Daher sollte, vor allem bei Patienten mit Diabetes melitus, vor und während der gesamten Operation, die Glucose überwacht und wenn nötig behandelt werden. [16, 17]
Vorbereitung des Patienten
Präoperative Haarentfernung: Das OP-Areal muss ausreichend großflächig geschoren werden (mindestens eine Handbreit um den erwarteten Schnitt). Die Schur der Haare sollte dabei außerhalb des OPs erfolgen und so hautschonend wie möglich durchgeführt werden (keine Nassrasur). Optimalerweise werden alle diagnostischen Maßnahmen, wie z. B. Röntgen, vor der Schur durchgeführt. Eine Schur unmittelbar vor dem Eingriff ist empfehlenswert. Maximal sollten 4 Stunden zwischen Schur und OP liegen. [18, 19]
Step-by-Step Anleitung
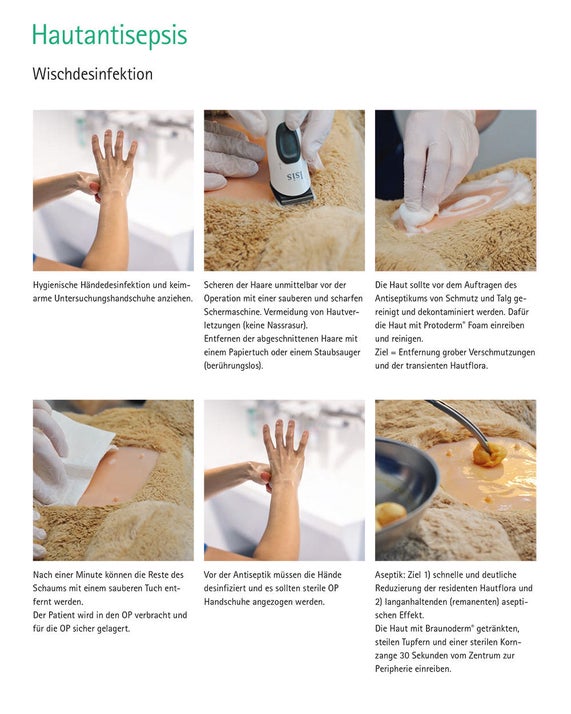
Haut- und Schleimhautantiseptik mit Alkohol PVP-Iod (Braunoderm®)
Wischdesinfektion
Step-by-Step Anleitung
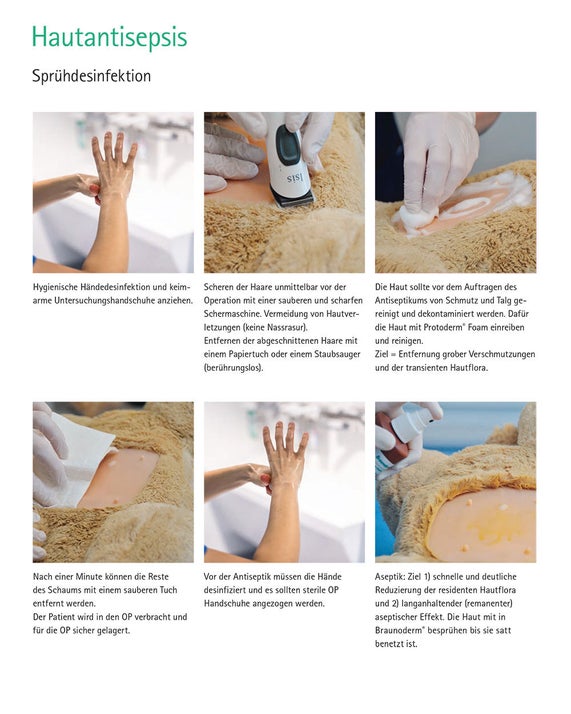
Haut- und Schleimhautantiseptik mit Alkohol PVP-Iod (Braunoderm®)
Sprühdesinfektion
Video
-
Hautdesinfektion – Sprühdesinfektion
mit Alkohol PVP-Iod (Braunoderm®)
Präoperatives Waschen: In der Humanmedizin wird empfohlen, dass sich die Patienten am Abend oder frühmorgens vor der OP gründlich waschen, [13, 20, 21] um eine deutliche Reduktion der Hautflora zu erreichen. Da dies für die tierischen Patienten schwer umzusetzen ist, sollte eine gründliche Reinigung des OP-Bereiches nach der Schur durchgeführt werden. Ziel ist die Reduktion der transienten Hautflora, sowie die Entfernung von Talg, Fett und Schmutz. Dabei sollte auf Wasser und Seife verzichtet werden, da diese die Wirkung des Antiseptikums (z. B. Alkohol) reduzieren können. [22] Die Reinigung der Haut kann mit einem Trockenschaum (Prontoderm® Foam) oder Reinigungslotion (Prontoderm® Solution) erfolgen. Das Produkt wird mit einer keimarmen Kompresse oder Tuch auf die geschorene Haut aufgetragen und die Haut gereinigt. Nach 1-2 Minuten die Überreste mit einem sauberen Tuch oder Tupfer abtrocknen.
Bei einer Waschung des Patienten zuhause durch den Besitzer, sollte das Fell des Patienten mit einem in Prontoderm® Solution getränkten Waschlappen oder mit Prontoderm® Foam gründlich eingerieben und gereinigt werden. Nach 3-5 Minuten das Fell mit einem sauberen Handtuch trockenreiben.
Antiseptik des OP-Feldes: Die Antiseptik nimmt eine Schlüsselfunktion in der Prävention der SSI ein, da durch die Durchtrennung der Haut eine Verschleppung der residenten Flora in die Tiefe des OP-Feldes möglich ist. Alkohol ist auf Grund seiner schnellen und guten Wirksamkeit das Mittel der ersten Wahl. [13, 20, 21] Kontrovers ist die Diskussion um den remanenten Wirkstoff. Traditionell ist in einigen Ländern PVP-Iod oder Chlorhexidin das Mittel der Wahl. Es gibt kontroverse Studien aus der Humanmedizin, die jeweils dem einen oder dem anderen Wirkstoff den Vorzug geben. In Metaanalysen der verschiedenen Studien hatte keines der beiden Antiseptika einen Vorzug gegenüber dem anderen. [21, 23] Allerdings ist die Wirkung von Chlorhexidin bei multiresistentem Staphyloccocus aureus im Vergleich zu PVP-Iod reduziert. [24] Andere Autoren berichten von einer Chlorhexidin-Resistenz bei Escherichia coli, Salmonella spp., Staphylococcus aureus oder koagulasenegativen Staphylokokken, Enterobacter spp., Pseudomonas spp., Proteus spp., Providencia spp. und Enterococcus spp. [25]
Wir empfehlen daher die Anwendung eines Alkohol PVP-Iod Präparates.
Die Haut des Patienten wird für 30 Sekunden mit einem sterilen in Braunoderm® getränkten Tupfer und unter Hilfenahme einer sterilen Kornzange mit Braunoderm® eingerieben. Dabei immer von dem erwarteten Schnittfeld sich nach außen vorarbeiten. Anschließend die Einwirkzeit des Herstellers beachten und dann den Vorgang noch 2-mal wiederholen. Für die Schleimhautantisepsis kommt PVP-Iod (Braunol®) oder Polyhexanid (Prontovet® Solution) in Betracht. [20]
Inzisionsfolie: Für die Verwendung von Inzisionsfolie in der Tiermedizin fehlen entsprechende Studien. In der Humanmedizin wird von nicht antiseptisch imprägnierten Inzisionsfolien abgeraten, da sie das SSI Risiko steigern können. [26]
Passende Produkte
Zudem finden Sie im AESCULAP® Chirurgische Instrumente Online-Katalog die passenden Kornzangen sowie Nierenschalen
Gezielte Prävention: Personal
Gezielte Prävention: Personal
Bereichskleidung: Soll eine Verschleppung von Bakterien in beide Richtungen verhindern. Auch wenn der infektionspräventive Effekt in keiner Vergleichsstudie dargelegt wurde, erscheint dieses Vorgehen als vorteilhaft, da die normale Berufskleidung mit fakultativ pathogenen Erregern, einschließlich MRE (Multiresistenten Erregern) kontaminiert sein kann. [27, 28]
Haarschutz und OP-Maske: Das Tragen von Haarschutz und OP-Maske sind plausibel. Die mikrobielle Belastung der Raumluft ist nachgewiesen, daher sollten beide Schutzmaßnahmen im OP-Saal und während der OP getragen werden. [29, 30]
OP-Schuhe und Schuh-Überzieher: Von außen eingeführte Bakterien vom Boden können den Bakteriengehalt in der Luft erhöhen und damit bis zu 15% zur Luftkontamination beitragen. [31, 32] Daher empfiehlt sich das Tragen von OP-Schuhen oder Überziehern.
Sterile Schutzkleidung: Die sterile Schutzkleidung stellt eine Barrierefunktion dar, die vor allem zum Schutz des OP-Personals wichtig ist. Einmal-OP-Kittel sind dabei deutlich weniger durchlässig für Bakterien als waschbare Baumwoll-Kittel und daher zu bevorzugen. [33, 34] Auch sind Einmal-OP-Kittel aus ökonomischer Sicht besser und können die SSI-Rate senken. [34-36]
Step-by-Step Anleitung
Schutzbrille: Eine Schutzbrille sollte bei allen Prozeduren, bei denen die Gefahr besteht, dass Körperflüssigkeiten oder potentiell infektiöses Material (z. B. septische Chirurgie, Zahnmedizin, Arbeiten mit oszillierenden oder rotierenden Geräten, Granulomen) verspritzt wird, getragen werden.
Händewaschung: Die Handwaschung ist der erste Schritt bei der Vorbereitung für den OP-Tag und sollte vor dem Anlegen der OP-Bereichskleidung durchgeführt werden. Wenn möglich sollte ein Abstand von mindestens 10 Minuten zwischen Händewaschung und alkoholischer Handdesinfektion liegen, da dadurch eine Verminderung der Wirksamkeit des Alkohols ausgeschlossen wird. [22] Auch sollte die Händewaschung nicht routinemäßig vor jeder OP durchgeführt werden, da durch das Waschen die Haut wiederholt entfettet wird und es dadurch zu Austrocknung und Schädigung der Haut kommt. [20] Sollte das Personal zwischen den Operationen den OP-Trakt verlassen und anderen Tätigkeiten nachgehen, sollte eine erneute Händewaschung vor dem Betreten des OP-Bereiches durchgeführt werden. Generell sollte die Händewaschung mit einer parfumfreien, pH-neutralen Seife, wie z. B. Softaskin® pure durchgeführt werden. Dabei sind 15-Sekunden Händewaschung ausreichend, um Sporen, Schmutz und Organismen deutlich zu reduzieren.
Step-by-Step Anleitung
Waschen der Hände
Waschen Sie Ihre Hände, wenn diese sichtbar verschmutzt sind! Verwenden Sie ansonsten Händedesinfektionsmittel. Gesamtdauer: 40-60 Sekunden
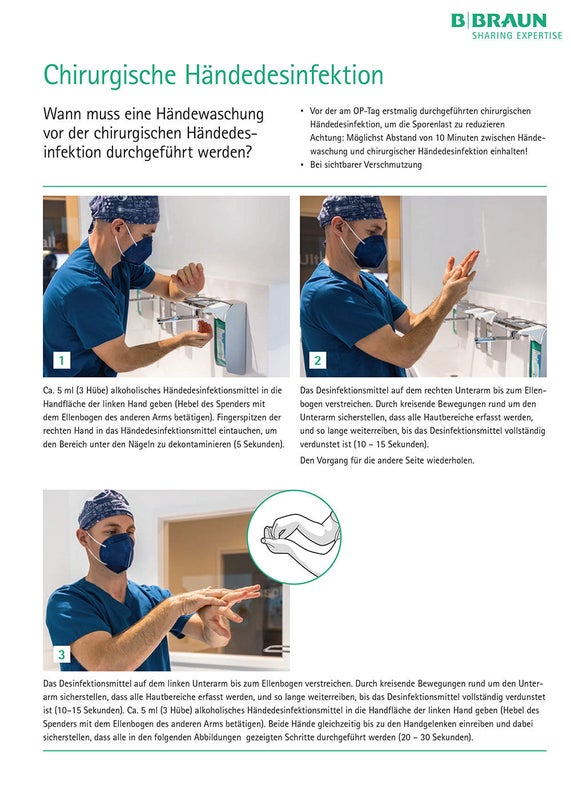
Chirurgische Händedesinfektion: Die chirurgische Händedesinfektion ist von dem gesamten Personal, welches an der OP beteiligt ist, und zudem vor jeder OP durchzuführen. Das Mittel der Wahl sind alkoholbasierte Präparate, wie z. B. Promanum® pure. Die Einreibung sollte mindestens zwei Minuten betragen (unabhängig von den Herstellerangeben, wenn unter 90 Sekunden). [37-41]
Step-by-Step Anleitung
Chirurgische Händedesinfektion
Wann muss eine Händewaschung vor der chirurgischen Händedesinfektion durchgeführt werden?
OP-Handschuhe: OP-Handschuhe gibt es in unterschiedlicher Qualität und in verschiedenen Materialien. Die Perforation der Handschuhe ist ein großes Problem während der OP. Dabei haben sich Latex-Handschuhe weniger perforationsanfällig gezeigt z. B. Vasco® OP-Grip / Vasco® OP-Sensitive. [42, 43] Die Handschuhe sollten erst nach vollständiger Trocknung der Hände nach der Händedesinfektion angezogen werden, da anderenfalls das Risiko von Perforationen steigt und mehr Hautirritationen begünstigt werden. Die Häufigkeit der Perforation des Handschuhs bei einer OP liegt zwischen 12,7% und 31%. Bei der Nutzung von zwei Handschuhen übereinander (Double-Gloving) liegt das Risiko der Perforation des inneren Handschuhs bei 3,8% bis 13%. [44-46]
Generell sollte der OP-Handschuhe alle 60 Minuten gewechselt werden. Auch sollte ein Wechsel der Handschuhe vor dem Einsetzen eines Implantats [45] und selbstverständlich auch nach Abschluss des „unsauberen Teils“ einer OP (z. B. nach Darmresektion) erfolgen.
Es gibt drei unterschiedliche Methoden, Handschuhe anzuziehen. Man unterscheidet in ‘geschlossen’, ‘offen’ oder ‘assistiert’. Dabei sollte die offene Methode nicht für chirurgische Eingriffe angewandt werden. Die sicherste Methode ist die assistierte, denn auch bei der geschlossenen Methode konnte eine Kontamination in 100% der Fälle nachgewiesen werden. Diese konzentrierte sich auf den Bereich der Manschette. [47]
Step-by-Step Anleitung
Fingernägel und Schmuck: Fingernägel sollten kurz geschnitten werden und mit der Fingerkuppe abschließen. [48] Das Tragen künstlicher Nägel konnte mehrfach mit nosokomialen Ausbrüchen in Verbindung gebracht werden und ist damit im OP auszuschließen. [49-51] Genauso sollte aufgrund der erhöhten Perforationsgefahr von OP-Handschuhen auf Schmuck (auch Eheringe) verzichtet werden. [52]
Gezielte Prävention im OP
Gezielte Prävention im OP
Antibiotikaprophylaxe: Die routinemäßige prophylaktische Gabe von Antibiotika wird nicht mehr empfohlen, da diese keinen signifikanten Einfluss auf die SSI-Rate bei sauberen oder sauber kontaminierten Operationen hat. [53-55]
Der Zeitpunkt der Antibiotikagabe sollte 60-120 Minuten vor dem Schnitt erfolgen, [53, 60] um einen maximalen Wirkspiegel zu erreichen und dann, wenn nötig, alle 90-120 Minuten wiederholt werden.
Operationsdauer: Die Operationszeit sollte so kurz wie möglich gehalten werden, [2, 4, 53] da das Risiko einer SSI sich ab der 70. bis 90. Minute OP-Dauer verdoppelt [3, 19] und ab der 120 Minute sich das Risiko im Vergleich zu einer 60 bzw. 30-minütigen OP versechsfacht. [53]
Operationstechnik: Generell gilt eine schonende Operationstechnik und eine atraumatische Behandlung des Gewebes als wichtige Voraussetzung für eine gute Wundheilung. [20]
Aseptische Spülung vor Wundverschluss: Aseptische Spülungen vor dem Wundverschluss führen zu einer deutlichen Reduktion der SSI Rate in der Humanmedizin. [20] Daher empfiehlt sich das Spülen der Wunde vor Verschluss mit Polyhexanidlösung (z. B. Lavasurge®).
Wundverschluss: Der Wundverschluss sollte mit möglichst feinem Nahtmaterial erfolgen. Eine Wundabdeckung mit Polyhexanidgel (Prontovet® Gel) ist vorteilhaft. [20]
Step-by-Step Anleitung
Instrumentarium: Das Instrumentarium muss steril sein. Eine hohe technische Qualität trägt zur Kürze der OP-Dauer und atraumatischen Gewebebehandlung bei. Das sterile Instrumentarium ist erst unmittelbar vor der OP abzudecken oder anzureichen, da es anderenfalls zur Kontamination durch Kontakt oder durch die in der Raumluft schwebenden Hautschuppen und Mikroflora des Personals kommt. [56, 57]
Personenanzahl: Viel Bewegung und Gespräche während der OP gehen mit einer erhöhten SSI Rate einher. Daher sollte die Personenzahl so gering wie möglich gehalten und Türen möglichst geschlossen bleiben. [58, 59]
[1] Seifert J. Aktuelle Hygienevorschriften in der Operationsabteilung unter besonderer Berücksichtigung baulich-funktionaler Maßnahmen. Chirurgie (Heidelb) 2022; 93(12):1197-206.
[2] Nicholson M, Beal M, Shofer F, Brown DC. Epidemiologic evaluation of postoperative wound infection in clean-contaminated wounds: A retrospective study of 239 dogs and cats. Vet Surg 2002; 31(6):577-81.
[3] Eugster S, Schawalder P, Gaschen F, Boerlin P. A prospective study of postoperative surgical site infections in dogs and cats. Vet Surg 2004; 33(5):542-50.
[4] Yap FW, Calvo I, Smith KD, Parkin T. Perioperative risk factors for surgical site infection in tibial tuberosity advancement: 224 stifles. Vet Comp Orthop Traumatol 2015; 28(3):199-206.
[5] Clark-Price S. Inadvertent Perianesthetic Hypothermia in Small Animal Patients. Vet Clin North Am Small Anim Pract 2015; 45(5):983-94.
[6] Rodriguez-Diaz JM, Hayes GM, Boesch J, Martin-Flores M, Sumner JP, Hayashi K et al. Decreased incidence of perioperative inadvertent hypothermia and faster anesthesia recovery with increased environmental temperature: A nonrandomized controlled study. Vet Surg 2020; 49(2):256-64.
[7] Beal MW, Brown DC, Shofer FS. The effects of perioperative hypothermia and the duration of anesthesia on postoperative wound infection rate in clean wounds: a retrospective study. Vet Surg 2000; 29(2):123-7.
[8] Fages A, Soler C, Fernández-Salesa N, Conte G, Degani M, Briganti A. Perioperative Outcome in Dogs Undergoing Emergency Abdominal Surgery: A Retrospective Study on 82 Cases (2018-2020). Vet Sci 2021; 8(10).
[9] Turk R, Singh A, Weese JS. Prospective surgical site infection surveillance in dogs. Vet Surg 2015; 44(1):2-8.
[10] Belda FJ, Aguilera L, La García de Asunción J, Alberti J, Vicente R, Ferrándiz L et al. Supplemental perioperative oxygen and the risk of surgical wound infection: a randomized controlled trial. JAMA 2005; 294(16):2035-42.
[11] Pryor KO, Fahey TJ, Lien CA, Goldstein PA. Surgical site infection and the routine use of perioperative hyperoxia in a general surgical population: a randomized controlled trial. JAMA 2004; 291(1):79-87.
[12] Greif R, Akça O, Horn EP, Kurz A, Sessler DI. Supplemental perioperative oxygen to reduce the incidence of surgical-wound infection. N Engl J Med 2000; 342(3):161-7.
[13] Berríos-Torres SI, Umscheid CA, Bratzler DW, Leas B, Stone EC, Kelz RR et al. Centers for Disease Control and Prevention Guideline for the Prevention of Surgical Site Infection, 2017. JAMA Surg 2017; 152(8):784-91.
[14] Kamal K, Powell RJ, Sumpio BE. The pathobiology of diabetes mellitus: implications for surgeons. J Am Coll Surg 1996; 183(3):271-89.
[15] Polk HC, Fry D, Flint LM. Dissemination and causes of infection. Surg Clin North Am 1976; 56(4):817-29.
[16] Espinel-Rupérez J, Martín-Ríos MD, Salazar V, Baquero-Artigao MR, Ortiz-Díez G. Incidence of surgical site infection in dogs undergoing soft tissue surgery: risk factors and economic impact. Vet Rec Open 2019; 6(1):e000233.
[17] Kroin JS, Buvanendran A, Li J, Moric M, Im H-J, Tuman KJ et al. Short-term glycemic control is effective in reducing surgical site infection in diabetic rats. Anesth Analg 2015; 120(6):1289-96.
[18] Mayhew PD, Freeman L, Kwan T, Brown DC. Comparison of surgical site infection rates in clean and clean-contaminated wounds in dogs and cats after minimally invasive versus open surgery: 179 cases (2007-2008). J Am Vet Med Assoc 2012; 240(2):193-8.
[19] Brown DC, Conzemius MG, Shofer F, Swann H. Epidemiologic evaluation of postoperative wound infections in dogs and cats. J Am Vet Med Assoc 1997; 210(9):1302-6.
[20] Robert-Koch-Institut (RKI). Prävention postoperativer Wundinfektionen. Bundesgesundheitsbl 2018; 61(4):448-73.
[21] Maiwald M, Widmer AF. WHO's recommendation for surgical skin antisepsis is premature. Lancet Infect Dis 2017; 17(10):1023-4.
[22] Hübner N-O, Kampf G, Löffler H, Kramer A. Effect of a 1 min hand wash on the bactericidal efficacy of consecutive surgical hand disinfection with standard alcohols and on skin hydration. Int J Hyg Environ Health 2006; 209(3):285-91.
[23] Marchionatti E, Constant C, Steiner A. Preoperative skin asepsis protocols using chlorhexidine versus povidone-iodine in veterinary surgery: A systematic review and meta-analysis. Vet Surg 2022; 51(5):744-52.
[24] Block C, Robenshtok E, Simhon A, Shapiro M. Evaluation of chlorhexidine and povidone iodine activity against methicillin-resistant Staphylococcus aureus and vancomycin-resistant Enterococcus faecalis using a surface test. J Hosp Infect 2000; 46(2):147-52.
[25] Kampf G. Acquired resistance to chlorhexidine - is it time to establish an 'antiseptic stewardship' initiative? J Hosp Infect 2016; 94(3):213-27.
[26] Webster J, Alghamdi A. Use of plastic adhesive drapes during surgery for preventing surgical site infection. Cochrane Database Syst Rev 2015; 2015(4):CD006353.
[27] Loh W, Ng VV, Holton J. Bacterial flora on the white coats of medical students. J Hosp Infect 2000; 45(1):65-8.
[28] Treakle AM, Thom KA, Furuno JP, Strauss SM, Harris AD, Perencevich EN. Bacterial contamination of health care workers' white coats. Am J Infect Control 2009; 37(2):101-5.
[29] Hubble MJ, Weale AE, Perez JV, Bowker KE, MacGowan AP, Bannister GC. Clothing in laminar-flow operating theatres. J Hosp Infect 1996; 32(1):1-7.
[30] Webster J, Croger S, Lister C, Doidge M, Terry MJ, Jones I. Use of face masks by non-scrubbed operating room staff: a randomized controlled trial. ANZ J Surg 2010; 80(3):169-73.
[31] Hambraeus A, Malmborg AS. The influence of different footwear on floor contamination. Scand J Infect Dis 1979; 11(3):243-6.
[32] Hambraeus A, Bengtsson S, Laurell G. Bacterial contamination in a modern operating suite. 3. Importance of floor contamination as a source of airborne bacteria. J Hyg (Lond) 1978; 80(2):169-74.
[33] Moylan JA, Balish E, Chan J. Intraoperative bacterial transmission. Surg Gynecol Obstet 1975; 141(5):731-3.
[34] Ward WG, Cooper JM, Lippert D, Kablawi RO, Neiberg RH, Sherertz RJ. Glove and gown effects on intraoperative bacterial contamination. Ann Surg 2014; 259(3):591-7.
[35] Moylan JA, Kennedy BV. The importance of gown and drape barriers in the prevention of wound infection. Surg Gynecol Obstet 1980; 151(4):465-70.
[36] Whyte W, Hodgson R, Bailey PV, Graham J. The reduction of bacteria in the operation room through the use of non-woven clothing. Br J Surg 1978; 65(7):469-74.
[37] Wheelock SM, Lookinland S. Effect of surgical hand scrub time on subsequent bacterial growth. AORN J 1997; 65(6):1087-92; 1094-8.
[38] O'Shaughnessy M, O'Malley VP, Corbett G, Given HF. Optimum duration of surgical scrub-time. Br J Surg 1991; 78(6):685-6.
[39] Kac G, Masmejean E, Gueneret M, Rodi A, Peyrard S, Podglajen I. Bactericidal efficacy of a 1.5 min surgical hand-rubbing protocol under in-use conditions. J Hosp Infect 2009; 72(2):135-9.
[40] Hsieh H-F, Chiu H-H, Lee F-P. Surgical hand scrubs in relation to microbial counts: systematic literature review. J Adv Nurs 2006; 55(1):68-78.
[41] Boothe DM, Boothe HW. Antimicrobial considerations in the perioperative patient. Vet Clin North Am Small Anim Pract 2015; 45(3):585-608.
[42] Korniewicz DM, Laughon BE, Butz A, Larson E. Integrity of vinyl and latex procedure gloves. Nurs Res 1989; 38(3):144-6.
[43] Fogg DM. Bacterial barrier of latex and vinyl gloves; AIDS attributed to bone allograft; disciplining problem employee. AORN J 1989; 49(4):1101, 1104-5.
[44] Ritter MA, French ML, Eitzen H. Evaluation of microbial contamination of surgical gloves during actual use. Clin Orthop Relat Res 1976; (117):303-6.
[45] McCue SF, Berg EW, Saunders EA. Efficacy of double-gloving as a barrier to microbial contamination during total joint arthroplasty. J Bone Joint Surg Am 1981; 63(5):811-3.
[46] Dodds RD, Barker SG, Morgan NH, Donaldson DR, Thomas MH. Self protection in surgery: the use of double gloves. Br J Surg 1990; 77(2):219-20.
[47] Newman JB, Bullock M, Goyal R. Comparison of glove donning techniques for the likelihood of gown contamination. An infection control study. Acta Orthop Belg 2007; 73(6):765-71.
[48] Hardy JM, Owen TJ, Martinez SA, Jones LP, Davis MA. The effect of nail characteristics on surface bacterial counts of surgical personnel before and after scrubbing. Vet Surg 2017; 46(7):952-61.
[49] Porteous J. Artificial nails… very real risks. Can Oper Room Nurs J 2002; 20(3):16-7, 20-1.
[50] Passaro DJ, Waring L, Armstrong R, Bolding F, Bouvier B, Rosenberg J et al. Postoperative Serratia marcescens wound infections traced to an out-of-hospital source. J Infect Dis 1997; 175(4):992-5.
[51] Parry MF, Grant B, Yukna M, Adler-Klein D, McLeod GX, Taddonio R et al. Candida osteomyelitis and diskitis after spinal surgery: an outbreak that implicates artificial nail use. Clin Infect Dis 2001; 32(3):352-7.
[52] Nicolai P, Aldam CH, Allen PW. Increased awareness of glove perforation in major joint replacement. A prospective, randomised study of Regent Biogel Reveal gloves. J Bone Joint Surg Br 1997; 79(3):371-3.
[53] Stetter J, Boge GS, Grönlund U, Bergström A. Risk factors for surgical site infection associated with clean surgical procedures in dogs. Research in veterinary science 2021; 136:616-21.
[54] Vasseur PB, Paul HA, Enos LR, Hirsh DC. Infection rates in clean surgical procedures: a comparison of ampicillin prophylaxis vs a placebo. J Am Vet Med Assoc 1985; 187(8):825-7.
[55] Daude-Lagravei A, Carozzo C, Fayolle P, Yiguier E, Viateau Y, Moissonnier P. Infection rates in surgical procedures: a comparison of cefalexin vs. a placebo. Vet Comp Orthop Traumatol 2001; 14(03):146-50.
[56] Bible JE, O'Neill KR, Crosby CG, Schoenecker JG, McGirt MJ, Devin CJ. Implant contamination during spine surgery. Spine J 2013; 13(6):637-40.
[57] Hemker T. Luftkeimzahlpegel während Operationen. Langenbecks Arch Chir 1983; 359(2):93-9.
[58] Ritter MA, Eitzen H, French ML, Hart JB. The operating room environment as affected by people and the surgical face mask. Clin Orthop Relat Res 1975; (111):147-50.
[59] Letts RM, Doermer E. Conversation in the operating theater as a cause of airborne bacterial contamination. J Bone Joint Surg Am 1983; 65(3):357-62.
[60] M. Hagen, Chris R., Singh, Ameet, Weese, J. S., Marshall, Quinn, and Thomas W. G. Gibson. "Contributing factors to surgical site infection after tibial plateau leveling osteotomy: A follow-up retrospective study." Veterinary Surgery 49, no. 5 (2020): 930-939. Accessed June 22, 2023.